Epigenetyka – wprowadzenie
W ostatnich dziesięcioleciach wykazano, że epigenetyka jest obiecującą dziedziną badań, ponieważ opisuje zmiany we wzorach dziedziczenia, które nie wymagają modyfikacji DNA i są związane z interakcjami między organizmem a środowiskiem. Znaki epigenetyczne to zmiany chemiczne, które zachodzą w chromosomach, i które powodują wyciszenie lub aktywację określonych genów w różnych tkankach. Zaobserwowano, że epigenetyka (a właściwie jej znaki) mogą powstawać w wyniku zmian środowiskowych i mogą być utrwalane przez wiele pokoleń. Istnienie dziedzicznych efektów niegenetycznych, które mają bezpośredni wpływ na fenotyp, zapewnia dodatkowy mechanizm zmienności, który pomaga nam zrozumieć pochodzenie obecnej różnorodności biologicznej.
Obiecujący parametr
Efekty epigenetyczne są wyraźnie widoczne, gdy analizowanym parametrem jest dieta. Oprócz wpływu na fenotyp osobnika, dieta może modulować fenotyp potomstwa. Na przykład u ssaków łożyskowych spodziewany jest efekt matczyny związany z dietą, biorąc pod uwagę podział dopływu krwi między matką i jej potomstwem. Rozwój embrionalny bezkręgowców jest jednak w dużej mierze niezależny od matki i środowiska macicy po zapłodnieniu. Dlatego obecność efektu matczynego u potomstwa bezkręgowców wynikająca z nawyków żywieniowych matek jest szczególnie intrygująca1. U niektórych bezkręgowców, takich jak Drosophila2 i Caenorhabditis elegans3, zaobserwowano już efekt matczyny związany z dostępnością do składników odżywczych. W tym artykule szczególna uwaga zostanie poświęcona badaniom dotyczącym epigenetycznego efektu matczynego, które wykorzystują C. elegans jako model.
Epigenetyka – przełom w badaniach
Nicień C. elegans został początkowo wyizolowany i opisany przez zoologa Émile Maupas na początku XX wieku. Ze względu na swoje unikalne cechy morfologiczne i fizjologiczne gatunek ten był wykorzystywany jako organizm modelowy w kilku obszarach badawczych oraz użyto go w badaniach przełomowych, które zostały nagrodzone nagrodami Nobla w 2002, 2006 i 2008 r.4 Badania oceniające dziedzictwo epigenetyczne u C. elegans związane z dietą koncentrowały się na szlaku insulinowym i wykazały, że wpływa on na procesy związane z rozwojem, starzeniem się, metabolizmem i odpornością na stres5. Zmiany na tym szlaku mogą być związane z wpływem efektu matczynego na plastyczność fenotypową potomstwa C. elegans. W tym kontekście Hibshman i współpracownicy6 wykazali, że poddane ograniczeniu kalorycznemu potomstwo C. elegans chronione jest przed głodem larwalnym i rośnie szybciej niż robaki, którym podano normalną ilość pokarmu. Wykazali również, że matczyna sygnalizacja insulinopodobna reguluje dostarczanie oocytów w odpowiedzi na dostępność składników odżywczych. Epigenetyka, która oferuje przeprogramowanie ścieżki insuliny wiąże się z rozwojem „fenotypu ekonomicznego”, który jest związany z większym nagromadzeniem tłuszczu wynikającym z racjonowania składników odżywczych. W normalnych warunkach takie nagromadzenie tłuszczu jest szkodliwe dla organizmu, ale może być niezwykle pozytywne, jeśli potomstwo musi przeżyć te same stresujące sytuacje, co jego rodzice, co czyni go lepiej przystosowanym do radzenia sobie ze stresem6.
Co ciekawe, u C. elegans istnieje ogólna sieć regulacyjna, która kontroluje odżywianie potomstwa podczas rozwoju embrionalnego, wielkość potomstwa oraz długość jego życia. Dlatego zmiany w spożyciu kalorii wywołują u C. elegans efekt plejotropowy, powodując jednoczesną modulację kilku aspektów fizjologicznych i metabolicznych, które mogą powodować zmiany wielkości, potencjału reprodukcyjnego i długości życia przez kilka pokoleń. Według Hibshmana i współpracowników6, występująca u C. elegans międzypokoleniowa i potencjalnie adaptacyjna funkcja insulinopodobnej sygnalizacji nie jest ograniczona do tego nicienia, ale w wielu innych organizmach można potwierdzić jej istnienie.
Parametr numer 2: temperatura
Oprócz diety u C. elegans zaobserwowano także epigenetyczne dziedzictwo związane z temperaturą. Na przykład Klosin i współpracownicy7 wykazali, że modyfikacje w ekspresji heterochromatycznych genów C. elegans wywołane wzrostem temperatury mogą trwać przez 14 pokoleń. Możemy zatem stwierdzić, że różnice w dostępie do pożywienia oraz w temperaturze mogą generować epigenetyczną pamięć, która trwa przez wiele pokoleń6,7.
Dziedzictwo epigenetyczne zilustrowane badaniami nad C. elegans pokazuje, że logika Lamarcka, która stwierdza, że organizm jest w stanie przystosować się do środowiska i przekazać te adaptacje potomstwu, w ograniczonym zakresie może zostać wykorzystana do wyjaśnienia procesów mikroewolucyjnych. W połączeniu z występowaniem mutacji w populacjach oraz procesami takimi jak selekcja naturalna i dryf genetyczny dziedzictwo epigenetyczne może wyjaśnić pochodzenie ogromnej różnorodności biologicznej na przestrzeni kilku pokoleń. Niektóre zmiany epigenetyczne mogą nawet spowodować początek mutacji, co potwierdziłoby znaczenie epigenetyki międzypokoleniowej dla zrozumienia procesów mikroewolucyjnych8. Na przykład mutagenność 5-metylocytozyn jest dziesięciokrotnie większa niż w przypadku cytozyn niezmetylowanych9.
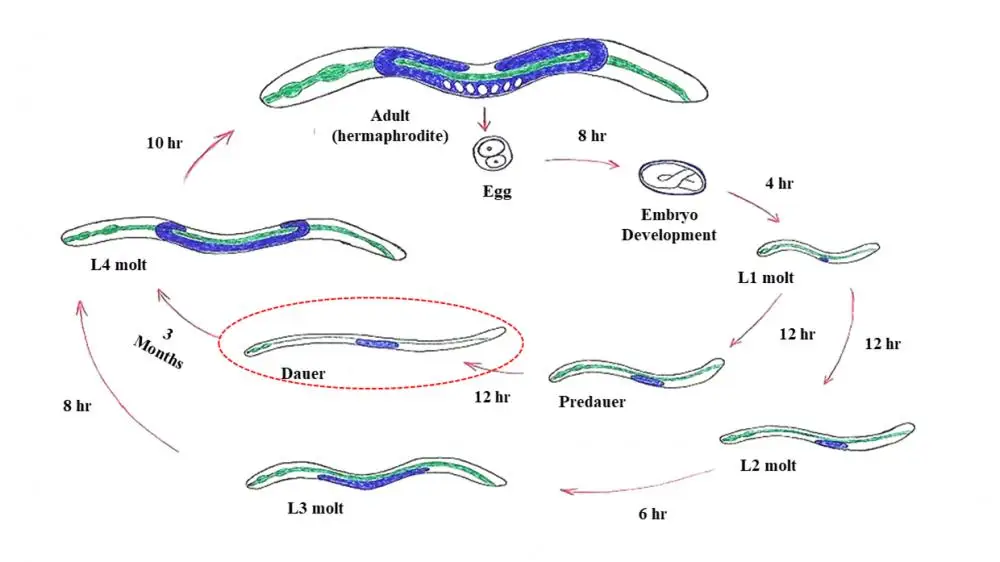
Dlatego zmiany warunków środowiskowych oraz dostępu do pożywienia mogą generować matczyne transkrypcyjne i translacyjne efekty plejotropowe przenoszone ze szczepów przodków na współczesne. Populacje każdej z tych linii rodowych mogły zostać od siebie odizolowane i mogły zasiedlić odrębne nisze, co spowodowałoby powstanie szerokiej gamy różnych fenotypów w ciągu kilku pokoleń. Różne wyzwania, z którymi musiały zmierzyć się takie linie rodowe, mogły doprowadzić do pojawienia się populacji o nadzwyczajnych strategiach przetrwania, jak zaobserwowano to na przykład u larw typu dauer C. elegans (ryc. 1).
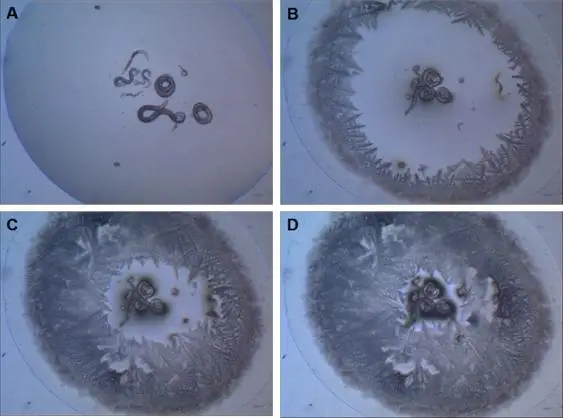
W tej strategii larwy L1 C. elegans (po wykluciu C. elegans przechodzi przez cztery stadia larwalne: L1-L4 – dop. tłum.), które znajdują się w stresujących sytuacjach (np. wysoka gęstość populacji, wysokie temperatury i niska dostępność pokarmu) wchodzą w alternatywne stadium rozwoju znane jako larwa dauer. Na tym etapie larwa jest w stanie tolerować odwodnienie, wchodząc w stan zawieszonej animacji (ametabolicznej) znanej jako anhydrobioza. Podczas zawieszonej animacji C. elegans jest w stanie wytrzymać ekstremalne warunki pod względem temperatury10, promieniowania11 oraz przyspieszenia grawitacyjnego4 (ryc. 2). Inne nicienie bardzo podobne do C. elegans są holo-anhydrobiotyczne, to znaczy wszystkie stadia tych robaków posiadają zdolność wejścia w stan zawieszonej animacji po odwodnieniu (ryc. 2). Wśród nich możemy wymienić Panagrolaimus superbus, który należy do tego samego rzędu (Rhabditida) co C. elegans i wykazuje niesamowite podobieństwa do tego gatunku. Ostatnio Souza i Pereira12 wykazali, że odwodnione robaki P. superbus mogą wytrzymać również ekstremalnie niską temperaturę (-196 °C) oraz wysokie dawki promieniowania (500 Gy promieniowania X).
Odporność nicieni na stresujące warunki może być związana z przeszłymi zmianami epigenetycznymi na przestrzeni wielu pokoleń. Możemy przypuszczać, że linie rodowe poddane kolejnym warunkom stresowym w ciągu kolejnych pokoleń doprowadziły do powstania szerokiej gamy organizmów o odrębnych genomach i odmiennych mechanizmach odporności na stres. Aby zrozumieć, w jaki sposób zmiany jakie epigenetyka spowodowała stresującymi sytuacjami mogą kształtować strukturę genomową organizmu, rozważmy inny gatunek nicieni zbliżony do C. elegans, C. briggae. Wiele podobieństw między tymi robakami wskazuje na ich wspólne pochodzenie. C. briggae i C. elegans mają tę samą liczbę chromosomów (6) i tę samą przybliżoną liczbę genów kodujących (19,500)13. Jednak genom C. briggae ma 104 Mbp, podczas gdy genom C. elegans ma tylko 100,3 Mbp. Różnica wielkości między tymi genomami wynika z większej ilości repetycyjnego DNA u C. briggae13. Co ciekawe, modyfikacje epigenetyczne mogą powodować kurczenie się lub ekspansję repetycyjnego DNA. Na przykład regulacja metylacji wysp CpG może modulować liczbę repetycyjnych regionów, zwiększając tempo ewolucji i prowadząc do zmian morfologicznych po kilku pokoleniach. Biorąc pod uwagę związek między wzorem metylacji genów a warunkami stresowymi, tempo ewolucji wzrosłoby w sytuacjach takich jak głód14.
Epigenetyka – co dalej?
Dlatego dziedziczenie epigenetyczne związane ze stresującymi warunkami może wyjaśniać zarówno pojawienie się strategii oporności, jak i wzrost zmian struktury genomowej, które mogły doprowadzić do drastycznych zmian morfologicznych w ciągu kilku pokoleń14. W tym kontekście należy zachęcać do badania wzorców dziedziczenia epigenetycznego u C. elegans w celu uzyskania lepszego zrozumienia procesów mikroewolucyjnych odpowiedzialnych za obecną różnorodność biologiczną. Jak sądze epigenetyka jeszcze nie raz pozwoli nam odkrycie wielu ciekawych tropów z przeszłości.
Przypisy
- Rando, O.J, Simmons, R. A. 2015. I’m Eating for Two: Parental Dietary Effects on Offspring Metabolism. Cell. Elsevier Inc.161: 93–105.
- Matzkin, L. M., Johnson, S., Paight, C., Markow, T. 2013. Preadult parental diet affects offspring development and metabolism in Drosophila melanogaster. PLoS One8: e59530.
- Frazier, H. N., Roth, M. B. 2009. Adaptive sugar provisioning controls survival of C. elegansembryos in adverse environments. Current Biology 19: 859–63.
- de Souza T. A., Pereira, T. C. 2018. Caenorhabditis elegansTolerates Hyperaccelerations up to 400,000 x g. Astrobiology 18(7):825-833.
- Murphy, C. T., Hu, P. J. 2013. Insulin/insulin-like growth factor signaling in C. elegans. WormBook. 1–43.
- Hibshman, J. D., Hung, A,, Baugh, L. R. 2016. Maternal Diet and Insulin-Like Signaling Control Intergenerational Plasticity of Progeny Size and Starvation Resistance. PLoS Genetics 12(10):e1006396.
- Klosin, A., Casas, E., Hidalgo-Carcedo, C., Vavouri, T., Lehner, B. 2017. Transgenerational transmission of environmental information in C. elegans. Science; 356(6335):320-323.
- You, J. S., Jones, P. A. 2012. Cancer genetics and epigenetics: two sides of the same coin? Cancer Cell 22(1):9-20.
- Rakyan, V., Whitelaw, E. 2003. Transgenerational epigenetic inheritance. Current Biology; 8;13(1):R6.
- Ujisawa, T., Ohta, A., Okahata, M., Sonoda, S., Kuhara, A. 2014.Cold tolerance assay for studying cultivation-temperature-dependent cold habituation in C. elegans.Protocol Exchange.
- Onodera, A., Yanase, S., Ishii, T., Yasuda, K., Miyazawa, M., Hartman, P. S., Ishii, N. 2010. Post-dauer life span of Caenorhabditis elegans dauer larvae can be modified by X-irradiation. Journal of Radiation Research51 (1): 67-71.
- Souza, T. A. J., Carli, G. J. and Pereira, T. C. 2017. Survival potential of the anhydrobiotic nematode Panagrolaimus superbussubmitted to extreme abiotic stresses. Invertebrate Survival Journal 14: 85-93.
- Stein, L. D., et al. 2003. The Genome Sequence of Caenorhabditis briggsae: A Platform for Comparative Genomics. PLoS Biol.1(2): e45.
- Ruden, D. M.; Garfinkel, M. D., Xiao, L., Lu, X. 2005.Epigenetic Regulation of Trinucleotide Repeat Expansions and Contractions and the “Biased Embryos” Hypothesis for Rapid Morphological Evolution. Current Genomics 6:3.